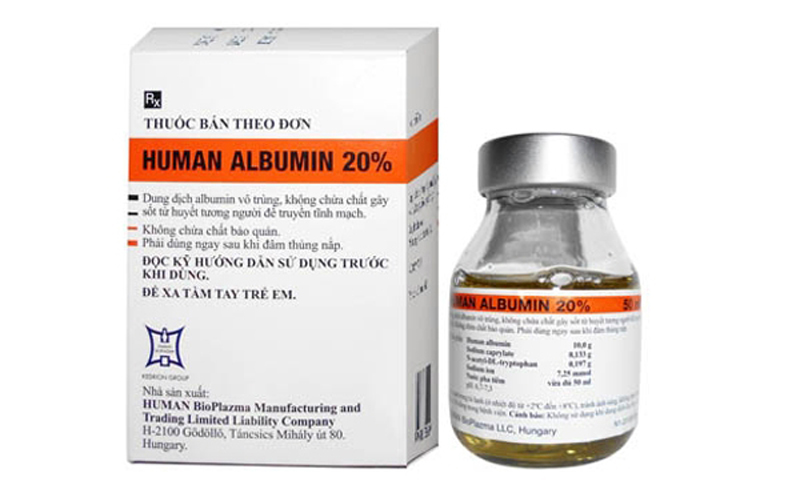
Vừa qua, Phó Cục trưởng Cục Quản lý Dược Nguyễn Tất Đạt đã ký công văn gửi các sở y tế, các bệnh viện và Công ty TNHH Bình Việt Đức; Công ty cổ phần Dược phẩm T.Ư CPC1; Công ty cổ phần Dược phẩm T.Ư Codupha về việc tạm dừng mua bán và sử dụng ba lô sinh phẩm y tế Human Albumin 20% vì nghi nhiễm bệnh Creutzfeld-Jakob (bệnh bò điên).
Công văn tạm ngừng lưu hành, sử dụng sinh phẩm Human Albumin 20% có nguồn gốc máu và huyết tương nghi nhiễm bệnh bò điên dựa trên thông báo của Ban Kinh tế - Thương mại, Phái đoàn Liên minh châu Âu tại Việt Nam kèm theo cảnh báo nhanh của Cục Quản lý dược Italy và Viện Dinh dưỡng và Dược phẩm quốc gia Hungary. Human Albumin 20% là dịch truyền để điều chỉnh và duy trì thể tích máu tuần hoàn sau khi đã xét nghiệm bị thiếu thể tích, trong trường hợp cần sử dụng dạng keo. Hiện tại, việc nhiễm bệnh Creautzfeld-Jakob cũng như chủng gây bệnh này chưa được khẳng định.
Lô sinh phẩm y tế có nguồn gốc từ máu và huyết tương do Công ty Kedrion Spa và Công ty Human BioPlazma Kft sản xuất có nghi ngờ khả năng nhiễm bệnh bò điên.
Theo báo cáo của Công ty TNHH Bình Việt Đức (trụ sở 62/36 Trương Công Định, phường 14, quận Tân Bình, TP Hồ Chí Minh) lô sinh phẩm trên đã được nhập vào Việt Nam. Ba lô sinh phẩm Human Albumin 20% (200g/l) nói trên lần lượt là: 29610616, 29700916, 29590616 đã được công ty CP dược phẩm Trung ương CP1 phân phối tại Việt Nam, quy cách lọ 50ml.
Để bảo đảm an toàn cho người sử dụng, trong thời gian chờ Cục Quản lý Dược phối hợp cùng Viện Dinh dưỡng và Dược phẩm quốc gia Hungary (OGYEI) kiểm tra và đánh giá tính an toàn của sản phẩm Human Albumin 200g/l, Cục Quản lý dược yêu cầu các sở y tế, các bệnh viện và các đơn vị kinh doanh dược tạm dừng mua bán, sử dụng lô sinh phẩm trên.
Đồng thời, các sở y tế khẩn trương thông báo đến các cơ sở khám chữa bệnh, đơn vị kinh doanh trên địa bàn tăng cường theo dõi, xử trí trường hợp phản ứng có hại của các thuốc trên. Nếu phát hiện phản ứng liên quan tới thuốc, cần báo cáo ngay về Trung tâm quốc gia về Thông tin thuốc và Theo dõi phản ứng có hại của thuốc (13-15 Lê Thánh Tông, quận Hoàn Kiếm, Hà Nội) hoặc Trung tâm khu vực về Thông tin thuốc và Theo dõi phản ứng có hại của thuốc tại TP Hồ Chí Minh (201B Nguyễn Chí Thanh, quận 5, TP Hồ Chí Minh).
Công văn cũng yêu cầu ba công ty Công ty TNHH Bình Việt Đức; Công ty cổ phần Dược phẩm T.Ư CPC1; Công ty cổ phần Dược phẩm T.Ư Codupha tạm dừng nhập khẩu, mua, bán và phân phối lô sinh phẩm y tế này, bảo quản đúng điều kiện ghi trên nhãn của sản phẩm. Đồng thời, thông báo đến các cơ sở kinh doanh, cơ sở điều trị tạm ngừng mua, bán, sử dụng sản phẩm Human Albumin 20% (200g/l) lọ 50ml và bảo quản theo đúng điều kiện ghi trên nhãn của sản phẩm trong trường hợp đã phân phối ra khỏi kho của công ty.
Cục Quản lý Dược cũng yêu cầu ba công ty này tổng hợp số lượng tồn kho sản phẩm Human Albumin 20% lọ 50ml của công ty, các cơ sở kinh doanh, các cơ sở điều trị để báo cáo về Cục trước ngày 20-9.
Công ty TNHH Bình Việt Đức phối hợp với nhà sản xuất – Công ty Human BioPlazma Manufacturing and Trading Limited Liability Company, Hungary tiếp tục theo dõi, cập nhật và báo cáo về tình hình lưu hành tại nước sở tại của sinh phẩm y tế Human Albumin 20% nêu trên và cung cấp thông tin liên quan đến việc xử lý của cơ quan quản lý nước sở tại đối với sản phẩm này.
Theo Nhandan